
Эндодонтия – раздел стоматологии, касающийся профилактики и лечения патологий пульпы и периодонта. Конечная цель – восстановление функции и эстетики пораженного зуба путем реставрации. Обтурация системы корневых каналов – важный этап в эндодонтическом лечении. Ее задача – герметизация каналов для предотвращения их повторного инфицирования. В приведенном клиническом случае показано использование силера МТА-Fillapex (Аngelus) в комбинации с гуттаперчевыми штифтами для обтурации во время эндодонтического лечения, проводимого за один сеанс.
Endodontics – branch of dentistry dealing with the prevention and treatment of pathologies of the pulp and periodontal. The ultimate goal – restoration of function and aesthetics of the tooth
affected by restoration. Obturation of root canal system – an important step in endodontic treatment. Its mission – to seal the channels to prevent them from re-reinfection. In the clinical case illustrates the use of sealer MTA-Fillapex (Angelus) in combination with guttapercha points for obturation during endodontic treatment, carried out in a single session.
Эндодонтия – раздел стоматологии, касающийся профилактики и лечения патологий пульпы и периодонта. Конечная цель – восстановление функции и эстетики пораженного зуба путем реставрации [1]. Обтурация системы корневых каналов – важный этап в эндодонтическом лечении. Ее задача – герметизация каналов для предотвращения их повторного инфицирования. Несмотря на эволюцию знаний в области внутриканальной микробиологии и внедрение новых инструментов для препарирования каналов с постоянным или переменным вращением, установлено, что невозможно полностью исключить патогенное действие микроорганизмов в канале. Однако известно, что значительное снижение уровня внутриканальной инфекции в большинстве случаев оказывается достаточным для достижения успеха [4]. Таким образом, к моменту обтурации необходимо создать внутри канала среду, неблагоприятную для роста и существования оставшихся бактерий. Следовательно, еще одна функция обтурации – предотвращение роста бактерий, не устраненных в процессе очистки или дезинфекции.
Для достижения желаемых целей эндоканальные силеры для обтурации должны:
- обладать способностью заполнять и герметизировать;
- иметь объемную стабильность после отверждения;
- быть нерастворимыми в органических тканевых жидкостях;
- иметь толщину пленки не более 50 мкм;
- быть рентгеноконтрастными;
- быть рентгеноконтрастными;
- обеспечивать хороший дренаж;
- не производить хроматических изменений в тканях;
- иметь соответствующее рабочее время;
- отвердевать и быть легко удаляемыми при необходимости;
- быть удобными и простыми в использовании;
- обеспечивать минерализацию;
- быть биосовместимыми и не оказывать раздражающего действия на периапикальные ткани [2];
Однако с развитием новых материалов и реабилитационных концепций в эпоху адгезивной стоматологии поиски двух важных характеристик приобретают все большее значение в разработке новых эндодонтических пломбировочных материалов. Одна из них – отсутствие эвгенола, который влияет на прочность адгезии смолы систем [6]. Вторая – биоактивность материала, то есть способность интегрироваться в окружающие ткани и субстанции организма, с которыми он находится в контакте.
Биологическая активность МТА (минерал триоксид агрегат), известная как биоминерализация, была впервые описана J.F. Reyes-Carmona в 2009 г. [3]. В одном из исследований in vitro авторы, получив изображения сканирующего электронного микроскопа, обнаружили интеграцию МТА с дентином путем наслоения (минерализации) многочисленных апатитовых групп на дентинные коллагеновые волокна по всей поверхности дентинных канальцев. Они также отметили: чем больше время контакта материала с дентином, тем обширнее минерализация. Можно с ответственностью говорить об улучшении адаптации и интеграции материала к дентину за счет минерализации [3, 5]. Название МТА происходит от составляющих его компонентов: трехкальциевый силикат, двухкальциевый силикат, оксид кальция и трехкальциевый алюминат.
Но низкая дренажная способность МТА не позволяет использовать его в качестве обтурирующего материала. Чтобы получить преимущество данного материала по биосовместимости, был разработан новый пломбировочный эндодонтический материал на основе МТА.
Клинический случай
Женщина, 56 лет, обратилась к стоматологу с жалобами на спонтанную пульсирующую боль в области левой челюсти, которая не прекращалась при применении анальгетиков и противовоспалительных препаратов. При обследовании установлено: отрицательный тест на апикальную пальпацию, вертикальная и боковая перкуссия всех зубов этого квадранта. Температурные тесты показали обостренный позитивный отклик зуба 36 на тепло и холод, продолжающийся длительное время. На другие зубы квадранта – легкий, короткий по продолжительности положительный ответ, чувствительность на холод,
отрицательная реакция на тепло.
В соответствии с классификацией Американской ассоциации эндодонтистов поставлен диагноз: необратимый пульпит зуба 36 с неизмененным периодонтом. Рекомендовано эндодонтическое лечение (рис. 1, 2).
Лечение проводили с использованием оперативного микроскопа, кратность которого варьировалась от х2,5 до х12,5. Доступ к пульповой камере осуществляли с помощью сферического алмазного бора с последующим использованием конусообразного алмазного бора. Формирование полости зуба завершили конической алмазной насадкой с ультразвуковым наконечником (E7D Helse, рис. 3, 4).
После обнаружения каналов К-файл № 10 осторожно ввели до 2/3 длины корневого канала согласно рентгеновскому снимку. Основное препарирование каналов продолжили инструментом № 25.06 (Reciproc-VDW) тремя последовательными возвратно-поступательными движениями с амплитудой около 1 мм в апикальном направлении. На каждом этапе препарирования проводили орошение 2,5%-ным раствором гипохлорита натрия (5,0 мл). Процедуру препарирования повторяли до тех пор, пока инструмент Reciproc № 25.06 не достиг заранее установленной длины. Для проверки апикальной проходимости
корневых каналов использовали К-файл № 10.
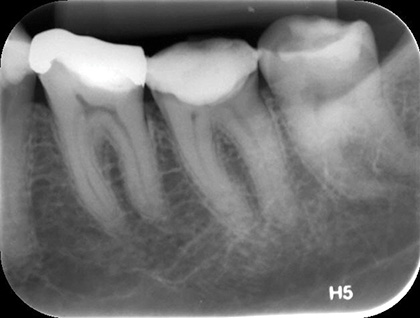
Рис. 1 Первичный рентгеновский снимок
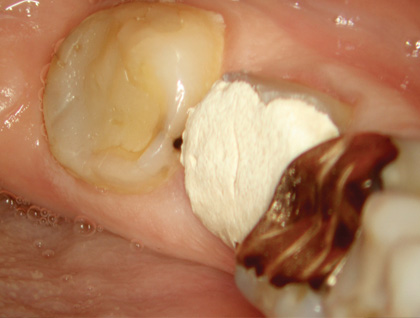
Рис. 2 Первичное клиническое состояние
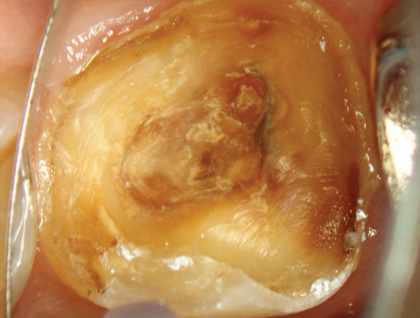
Рис. 3 Клиническая картина после удаления временной пломбы
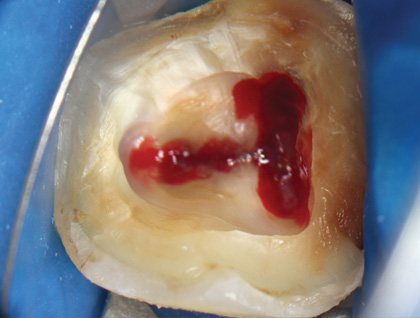
Рис. 4 Раскрытие пульповой камеры и локализация устьев канала
Следующий шаг – проведение электронной апекслокации для установления реальной рабочей длины каналов. Рабочую длину и диаметр апикального отверстия зоны определяли, вводя ручные К-файлы различного размера до тех пор, пока не был подобран подходящий инструмент, адаптированный на всю рабочую длину, к боковым стенкам и апикальному отверстию. В мезиальных каналах использовали инструмент № 30 с рабочей длиной 19 мм, адаптированной к апексу, в дистальном канале – инструмент № 40 с рабочей длиной 20 мм. Мезиальные каналы были препарированы инструментом Reciproc 40
(VDW), дистальный – инструментом Reciproc 50 (VDW) на установленные рабочие длины. Препарирование сопровождалось обязательным орошением корневого канала 2,5%-ным раствором гипохлорита натрия (5,0 мл).
После окончательного формирования предварительно высушенные каналы заполнили 17%-ным раствором EDTA-T, провели три цикла по 15 с пассивной ультразвуковой активации с использованием наконечника Irrisonic (Helse), восполняя раствор для каждого цикла.
Затем каналы вновь оросили 2,5%-ным раствором гипохлорита натрия (5,0 мл). Основные гуттаперчевые конусные штифты размером 0.06 и 0.08 проверили и адаптировали к каналам по рабочей длине и апикальному отверстию. Каналы просушили с помощью аспирационного микро-катетера, подключенного к вакуумному отсасывателю (рис 5, 6).
Силер МТА-Fillapex (Angelus) ввели в каналы при помощи основных гуттаперчевых штифтов. Излишки штифтов срезали с помощью термопластической системы (Touch’n Heat Sybron Endo) и вертикально уплотнили.

Рис. 5 Сформированные каналы после медикаментозной обработки
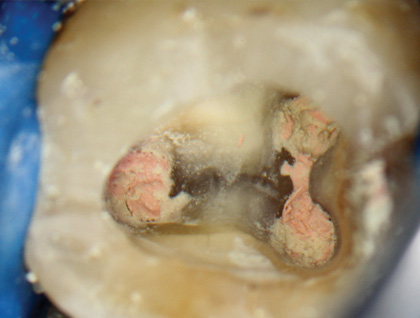
Рис. 6 Каналы, запломбированные гуттаперчей с MTAFillapex
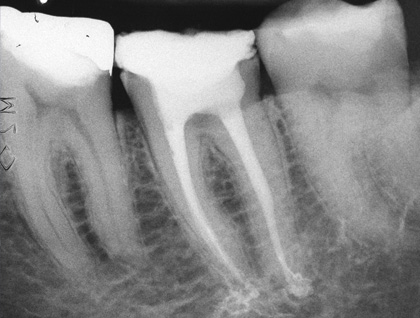
Рис. 7 Финальный рентгеновский снимок
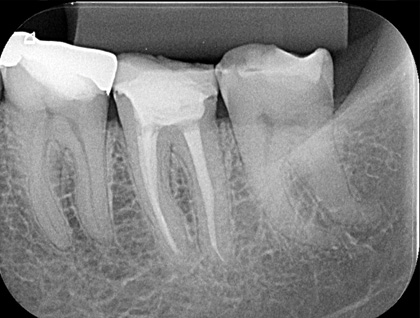
Рис. 8 Контрольный рентгеновский снимок через 17 мес
Координаты для связи с авторами:
leandroapp@gmail.com – Леонардо А.П. Перейра
СПИСОК ЛИТЕРАТУРЫ
1. Glickman G.N. AAE Consensus Conference on Diagnostic Terminology: background and perspectives. – J. Endod., 2009, № 35 (12), р. 1619–1620.
2. Hargreaves K.M., Cohen S., Berman L.H. Cohen’s Pathways of the Pulp. – London: Mosby Elsevier, 2011, 450 р.
3. Reyes-Carmona J.F., Felippe M.S., Felippe W.T. Biomineralization ability and interaction of mineral trioxide aggregate and white portland cement with dentin in a phosphate-containing fluid. – J. Endod., 2009, № 35 (5), р. 731–736.
4. Siqueira J.F.-Jr., Rôças I.N. Clinical Implications and Microbiology of Bacterial Persistence after Treatment Procedures. – J. Endod., 2008, № 34 (11), р. 1291–1301.
5. Torabinejad M.L., Hong C.U., McDonald F. et al. Physical and chemical properties of a new root-end filling material. – J. Endod., 1995, № 21 (7), р. 349–353.
6. Vano M., Cury A.H., Goracci C. et al. The effect of immediate versus delayed cementation on the retention of different types of fiber post in canals obturated using a eugenol sealer. – J. Endod., 2006, № 32 (9), р. 882–885.
