Краткий обзор – целью данного исследования было оценить реакцию подкожных соединительных тканей крыс на имплантированные полиэтиленовые тубы, заполненные минеральным триоксидом агрегейтом MTA FILLAPEX® для сравнения с реакцией на тубы, заполненные Sealapex® или Angelus MTA®. Эти материалы были помещены в полиэтиленовые тубы и имплантированы в дорсальную соединительную ткань крыс породы Wistar на срок 7, 15, 30, 60 и 90 дней. Образцы окрашивались гематоксилином и эозином или фон Косса или, наоборот, оставлялись неокрашенными для обследования в поляризованном свете. Полученные качественные и количественные оценки реакций проанализированы. Все материалы вызвали умеренную реакцию после 7 дней, которая уменьшалась со временем. Наблюдаемые реакции были умеренными и схожими на контрольный образец MTA и Sealapex® на 15-й день. МТА FILLAPEX (®) и Angelus МТА® вызывали средние (умеренные) реакции, начинавшиеся после 15 дня. В поляризованном свете двойного лучепреломления наблюдалась минерализация и грануляция со всеми материалами. Сделаны выводы, что МТА FILLAPEX® биосовместим и стимулирует минерализацию.
Как правило, основной целью эндодонтического лечения является правильная очистка и формирование системы корневого канала с последующим заполнением канала гуттаперчей с силером (пломбировочным герметиком). В идеале, силеры должны иметь благоприятные физические и химические свойства для этого(1). Кроме того, весьма желательно, чтобы пломбировочные силеры были биосовместимы, т.к. они могут быть в непосредственном контакте с тканями пародонта через апикальное отверстие и дополнительные каналы. Поскольку они могут влиять неблагоприятно и задерживать заживление ран, то важно изучение реакции тканей на эти силеры до их клинического применения (2).
Наличие и выделение веществ из силера могут вызывать различные реакции при контакте с тканями. Реакция варьируется в зависимости от веществ, которые использовались суммарно, а также от скорости их растворения. Sealapex® (SybronEndo, Glendora, Калифорния, США) — это cилер, содержащий оксид кальция (САО), который в контакте с водой образует гидроксид кальция (Са(ОН)2) (3, 4). Sealapex® показал, что вызывает лишь умеренную воспалительную реакцию при контакте с периапикальными тканями (2, 3, 5).
Минерал триоксид агрегат МТА был достаточно всесторонне изучен. Он был разработан для использования при патологической, или ятрогенной, перфорации и апикального пространства канала корня (6,7). Исследования показали, что реакция тканей благоприятна на МТА, характеризуется отсутствием тяжелых воспалительных реакций, образованием фиброзной капсулы и вызывает восстановление минерализованных тканей (8, 9). Однако, не смотря на благоприятные характеристики, МТА не обладает физическими свойствами, необходимыми для использования в качестве силера, из-за неподходящего рабочего времени, неудобства и сложности при применении(1,10).
Недавно был представлен герметик на базе МТА (Angelus®; Londrina, Parana,Бразилия). Это герметик паста-паста, состав которого пока является коммерческой тайной. Однако, известно, что синтетический Portland Cement clinkers, который является основным материалом темно-серого цвета, изготовленный путем нагревания молотого известняка и глины при температуре примерно 1400-1500°С, и дисалицилат являются основными компонентами и образуют ионный полимер. Согласно производителю, он имеет следующие физические свойства: рабочее время 35 мин; фильтрационная емкость 27.66 мм; сроки схватывания 130 мин; оптическую плотность 77%; и растворяемость 0.1%. Кроме того, он удобен и прост в применении. Однако, ни в одном из проведенных исследований не оценены его биологические характеристики. Таким образом, целью данного исследования было сравнение тканевых реакций на МТА FILLAPEX, Sealapex и Аngelus МТА в подкожных соединительных тканях крыс, в том числе их способность стимулировать минерализацию.
Материал и методы
Для этого исследования были использованы тридцать самцов белых крыс породы Wistar Albino в возрасте от 4 до 6 месяцев, весом 250-280 г. Животные размещались в клетках с контролируемой температурой и получали неограниченно воду и корм.


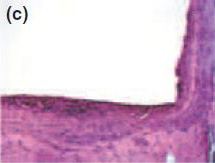


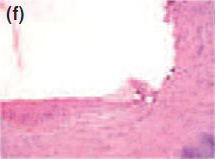






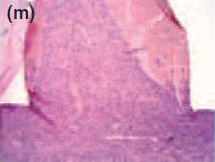



Рис. 1Спустя 7 дней, формирование толстой фиброзной капсулы и умеренной воспалительной клеточной инфильтрации наблюдались с Sealapex® (а),FILLAPEX® (е), Angelus MTA® (i) и контрольной группой (m). Спустя 15 дней, обратите внимание, что фиброзная капсула осталась утолщенной с умеренным воспалительным клеточным инфильтратом с Sealapex® (b), но более тонко с незначительной(умеренной, легкой) воспалительной клеточной инфильтрацией с FILLAPEX® (f),Аngelus MTA® (j), и контрольной группой(n). Cпустя 60 и 90 дней, толщина фиброзной капсулы и количество воспалительных клеток уменьшились со стороны тубы инфильтрации с Sealapex® (c,d соответственно), FILLAPEX® (g,h), Аngelus MTA® (к,L), и контрольная группа (o,p). Гемотоксилин иозин 100x кратно.
Уход за животными осуществлялся согласно одобрения проектом до начала эксперимента Комитетом по Этике Стоматологической Школы, Аракатуба, (Aracatuba School of Dentistry-UNESP Ethical Committee).
Девяносто полиэтиленовых туб (Abbot Labs Бразилии, Сан-Паулу, Бразилия) с внутренним диаметром 1.0 мм, внешним диаметром 1.6 мм, и 10.0 мм длиной использовались в качестве контейнеров для тестового материала. Sealapex®, МТА FILLAPEX®, и Angelus MTA® были подготовлены согласно рекомендациям производителя и заполнены каналонаполнителем (lentulo spiral Dentsply Maillefer, Талса, ОК,США) в тубы. Тридцать полиэтиленовых труб оставались пустыми в качестве контрольных.
Кожные покровы животных были продезинфицированы 5% раствором йода, после чего они были острижены под ксилазин (10 мг / кг-1)и применен кетамина (25 мг / кг-1) в качестве анестезии. Был сделан разрез 2 см в направлении голова–хвост на бритой спине каждого животного лезвием №15( Bard-Parker-ParkerTM Franklin Lakes, Нью-Джерси, США). Кожа была раздвинута, чтобы создать два кармана на расстоянии 6 см друг от друга на каждой стороне разреза, один в черепной части и другой в хвостовой части тела. После того, как тубы были имплантированы в в разрезы, кожа была закрыта путем наложения швов с 4/0 шелковой нитью.
По прошествии времени 7, 15, 30, 60 и 90 дней от имплантации, шесть животных погибли от передозировки обезболивающего средства. Тубы с окружающими тканями были удалены и фиксированы в 10% растворе формалина с буфером при pH 7.0 (11, 12). Тубы были разрезаны пополам в поперечном направлении. Обе половины разрезаны снова продольно острым лезвием, чтобы позволить поверхностям обеспечить непосредственный контакт с обрабатываемыми поверхностями. Образцы были обработаны метакрилат гликолем (glycol methacrylate Embedding), разделеные на серии по 3- µm и тонированы гемотоксилином иозином (hematoxylin-еosin ) (13). 10-µm части были окрашены в соответствии с техникой Von Kossa или оставлены неокрашенными для наблюдений в поляризованном свете. Эта методика была использована для того, чтобы окрасить минерализованные структуры. Техника поляризованного света продемонстрировала структуры двойного лучепреломления, относящиеся к кристаллам карбонат кальция, образующиеся из комбинаций ионов кальция из материала и углекислого газа из окружающих тканей (14).
Воспалительные реакции в тканях в контакте с материалом на открытом конце трубки были отмечены в соответствии с данным предыдущих исследований (12, 13, 15, 16) следующим образом: 0 — нет или несколько воспалительных клеток и отсутствие реакции; 1 — < 25 клеток и слабая реакция; 2 — между 25 и 125 клеток и умеренная реакция; 3, 125 или более клеток и тяжелая реакция.
Фиброзные капсулы считались тонкими, когда они < 150 µm и считались толстыми при ≥ 150µm. Некроз и кальцификация были записаны в µm2 в соответствии с программным обеспечением Leica QWin (Leica Microsystems, Wetzlar, Германия). Для каждой группы было получено среднее количество клеток в 10 отдельных регионах (400 х кратность увеличения). Анализы были выполнены анонимно единственным стандартизированным оператором. Результаты были статистически проанализированы с помощью односторонних ANOVA Kruskal-Wallis тестов.
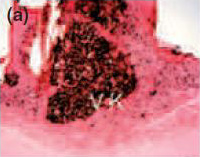



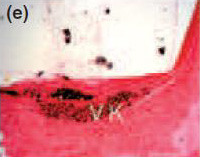

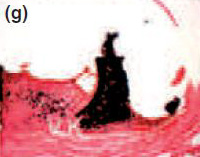



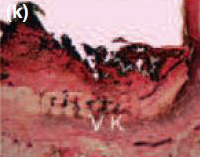



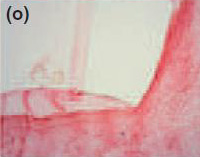

Рис. 2Спустя 30 и 90 дней, обратите внимание на наличие дистрофической кальцификации на отверстии тубы с Sealapex® (а,с, соответственно),FILLAPEX® (е,g), Аngelus MTA® (i,k), но не с контрольным образцом(m,o). Von Kossa 100х кратно. Спустя 30 и 90 дней, наблюдалось наличие двойного лучепреломления поляризованном свете, подтверждающие минерализационную индукцию с Sealapex® (b,d, соответственно), FILLAPEX® (f,h), Аngelus MTA® (j,l), но не с контрольным образцом(n,р). Поляризованный свет 100х кратно.
Результаты
Материалы тестов
Для всех протестированных материалов в фиброзных капсулах на 7-й день наблюдалась умеренно воспаленная инфильтрация клеток, состоящая из лимфоцитов и макрофагов (рис. 1а, е, i). Интенсивность воспаления снизилась на 15, 30, 60 и 90 день в тонких фиброзных капсулах рядом с тубами и почти без воспалительных клеток для всех протестированных материалов, кроме для Sealpex®, которые имели интенсивное воспаление, снижающееся после 30 дня (рис. 1b-d, f-h, j-l). Для всех испытываемых материалов рядом с отверстиями туб наблюдались грануляции в поляризованном свете двойного лучепреломления и позитивность теста Von Kossa (Рис. 2).
Контроль (пустые трубы)
В фиброзных капсулах на 7 и 15 день наблюдалась умеренная хроническая воспалительная клеточная инфильтация, состоящая из лимфоцитов и макрофагов(Рис. 1 m,n). Фиброзные капсулы, окружающие тубы, были тонкими с несколькими хроническими воспалительными клетками через 30, 60 и 90 дней (Рис.1 о,р). Отрицательный тест Von Kossa или двойное лучепреломление структур (Рис. 2 m-p) не наблюдались.
Сравнения между группами
Данные были сопоставлены для каждой временной точки, как показано на рисунке в табл. 1. Спустя 7 дней, не было никаких статистически значимых различий среди множества различных групп (средний показатель 2) за исключением Sealapex®. Sealapex® вызвал больше некроза и кальцификаций (Р < 0,001). Не было никаких статистически значимых различий в воспалительных клеточных показателях между группами МТА FILLAPEX® и Angelus MTA®, и между Sealapex® и контрольной группами, спустя 15 дней. Однако показатели среднего количества воспалительных клеток для групп МТА FILLAPEX® и Angelus MTA® (средний показатель – 1 балл) были ниже, чем у других групп (средний показатель – 2 балла) (р < 0,001). Sealapex® и Angelus MTA® вызвали больше кальцификации, чем МТА FILLAPEX®. Спустя 30, 60 и 90 дней не было никаких статистически значимых различий по воспалительным показателям для различных групп (средний показатель 1).Однако, значительно больше участков минерализации было в группе Sealapex®, чем в других группах (Р < 0,001).
Таблица 1. Процентное содержание образцов в каждой группе, классифицированное согласно оценки воспаления, наличия некроза и толщины фиброзной капсулы.
| Материал | Оценка | ||||||
| 0 | 1 | 2 | 3 | Кальцификация | Некроз | Капсула | |
| 7 дней | |||||||
| Контроль | 0 | 0 | 100 | 0 | 0α1 | 0α1 | толстая |
| Sealapex | 0 | 0 | 100 | 0 | 186968.7b3 | 266519.7d4 | толстая |
| FillApex | 0 | 0 | 100 | 0 | 64849.6с2 | 90327.4b2 | толстая |
| МТА | 0 | 0 | 100 | 0 | 55464.0с2 | 176535.0с2 | толстая |
| 15 дней | |||||||
| Контроль | 0 | 0 | 100 | 0 | 0α1 | 0α1 | толстая |
| Sealapex | 0 | 0 | 100 | 0 | 191671.5b3 | 201183.7b3 | толстая |
| FillApex | 0 | 100 | 0 | 0 | 20007.1с2 | 0α1 | тонкая |
| МТА | 0 | 100 | 0 | 0 | 172246.8b3 | 0α1 | тонкая |
| 30 дней | Контроль | 0 | 100 | 0 | 0 | 0α1 | 0α1 | тонкая |
| Sealapex | 0 | 100 | 0 | 0 | 342533.8b4 | 0α1 | тонкая |
| FillApex | 0 | 100 | 0 | 0 | 189488.0с3 | 0α1 | тонкая |
| МТА | 0 | 100 | 0 | 0 | 153184.8с3 | 0α1 | тонкая |
| 60 дней | |||||||
| Контроль | 0 | 100 | 0 | 0 | 0α1 | 0α1 | тонкая |
| Sealapex | 0 | 100 | 0 | 0 | 341080.5b4 | 0α1 | тонкая |
| FillApex | 0 | 100 | 0 | 0 | 121466.7с3 | 0α1 | тонкая |
| МТА | 0 | 100 | 0 | 0 | 106930.8с3 | 0α1 | тонкая |
| 90 дней | |||||||
| Контроль | 0 | 100 | 0 | 0 | 0α1 | 0α1 | тонкая |
| Sealapex | 0 | 100 | 0 | 0 | 240491.3ba4 | 0α1 | тонкая |
| FillApex | 0 | 100 | 0 | 0 | 121963.1с3 | 0α1 | тонкая |
| МТА | 0 | 100 | 0 | 0 | 110484.7с | 0α1 | тонкая |
Обсуждение
В этом исследовании пустые тубы вызвали несколько реакций в подкожной соединительной ткани, подобно предыдущим отчетам о полученных результатах (2, 12, 17).
В этом исследовании МТА FILLAPEX® вызвал умеренную хроническую воспалительную реакцию на 7-й день, которая снизилась в короткий промежуток времени (15 дней), аналогично Angelus MTA®, и более быстро, чем индуцирует Sealapex®. Во время всех периодов наблюдения положительные участки Von Kossa для кальция и структур двойного лучепреломления наблюдались аналогично тем, которые были получены в реакциях на Angelus MTA® (18). Эти кальцификации, как полагают, происходят от СаО, присутствующего в MTA FILLAPEX® и в MTA (14,19).
При контакте с водой, СаО превращается в СА(ОН)2 и диссоциируется на Ca22+ и OH—.
Диффузия проникновения ионов гидроксильной группы из корневого канала повышает рН на поверхности корня, прилегающего к тканям пародонта, возможно, воздействует на остео-интегрирующую активность и содействует ощелачиванию в прилегающих тканях, что способствует заживлению(19,20).Ионы кальция участвуют в активации кальций-зависимого аденозин трифосфотазы (adenosine triphosphatase) (19, 21) и реагируют с углекислым газом, образуя кристаллы карбоната кальция (двойное лучепреломление в поляризованном свете), которые служат ядром для кальцификации и полезной минерализации (19, 21). Богатая внеклеточным фибронектином сеть, в тесном контакте с этими кристаллами, интенсивно поддерживает роль кристаллов кальцита и фибронектина, как инициирующий шаг в образование твердой ткани (19, 21). Кальций также необходим для клеточной миграции и дифференциации (19, 22).Так как МТА FILLAPEX® и МТА имеют сходный химический состав и производят аналогичную реакцию на ткани, предполагается, что МТА FILLAPEX® будет действовать аналогично МТА при использовании в клинических ситуациях, но будет легок при использовании, благодаря его сочетанию паста-паста.
Sealapex® был разработан в качестве герметика и был использован в настоящем исследовании в качестве эталона. Результаты, полученные с Sealapex®, были аналогичны результатам контрольной группы. Умеренная хроническая воспалительная реакция, наблюдаемая изначально, снизилась с течением времени одновременно с присутствием позитивных участков Von Kossa и структур двойного лучепреломления, показывая, что этот материал стимулировал образование минерализованной ткани. Эти кальцификации могут происходить от СаО, присутствующего в Sealapex®, который, вступая в реакцию с тканевой жидкостью,образовывает Са(ОН)2 (14). В грануляциях двойного лучепреломления, наблюдаемых рядом с Sealapex®, вероятно, были кристаллы кальцита, которые возникли из реакции ионов кальция с углекислым газом в тканях (14, 23). Интересно, что больше кальцифицировнных участков наблюдалось в группе Sealapex®, чем в других группах. Вероятно, это было связано с различием в составе материалов, результатом чего проявилось различие в степени ионного растворения.
Минерал триоксид агрегейт, в основном, использовался для восстановления перфораций или же для пломбирования апикальной части корня с хорошей биосовместимостью (24). Он имеет способность индуцировать твердые тканевые образования пульповой ткани, когда используется для прямого наложения, или при пульпотомии(25-29). Исследования на животных подтвердили, что MTA индуцирует формирование структурно высшего качества дентин намного лучше, по сравнению с гидроокисью кальция Ca(OH)2 (25 ,26,29).
В заключение, в исследованиях на крысах, MTA FILLAPEX® воспроизводит похожую реакцию тканей на Angelus MTA® и Sealapex®, в том числе стимуляции к минерализации. Таким образом, можно утверждать, что МТА FILLAPEX® является биологически совместимым материалом. Дальнейшие исследования необходимы, чтобы лучше изучить характеристики и поведение этого материала.
По материалам журнала: Стоматологическая травматология 2011
