
Джузеппе Кантаторе
Университет Вероны (Италия).
Кафедра эндодонтии. Доцент.
В классическом исследовании, опубликованном в 1985 г., Bystrom et Al. провели сравнение стерилизующей эффективности трех разных методов эндодонтической обработки инфицированных каналов и установили, что механическая обработка в сочетании с ирригацией физиологическим раствором обеспечивает стерильность каналов в 20% случаев, в то время как замена NaCl на 5% раствор гипохлорита натрия приводит к стерильности каналов в 50% случаев, а дополнение последней схемы однократным временным пломбированием канала гидроксидом кальция повышает процент стерилизации каналов до 97%. Означает ли это, что при лечении инфицированных корневых каналов во всех случаях требуется временное пломбирование лечебной пастой? Со времени исследования Bystrom et Аl прошло более 15 лет; сегодня мы знаем гораздо больше о свойствах микроорганизмов, связанных с пульпо-периодонтальной патологией: от вирулентности до подвижности, от способности проникать в дентиннные канальцы до чувствительности к различным антисептикам. 15-летний опыт исследований показал, что многие ирригационные растворы обладают выраженной бактерицидностью по отношению к таким микроорганизмам как enterococcus faecalis илиcandida, которые обладают резистентностью к гидроксиду кальция или хлорофенолу. В данной статье мы обсудим по 7 пунктам как усовершенствовать процедуру ирригации корневых каналов, используя правильные средства в правильной последовательности, с тем, чтобы сократить необходимость в дополнительном медикаментозном воздействии на каналы между посещениями.
Ключевые факторы эффективной очистки и ирригации системы корневых каналов
1. Тщательная диагностика имеющейся пульпо-периодонтальной патологии
2. Учет состояния тканей зуба и сложности анатомии системы корневых каналов
3. Удаление эндодонтического смазанного слоя
4. Соблюдение показаний при выборе средств для ирригации
5. Оптимизация активных компонентов ирригационного раствора
6. Правильная последовательность применения ирригационного раствора в ходе обработки корневых каналов
7. Обязательные затраты не менее 5 мин на ирригацию перед пломбированием
1 — Диагностика патологии пульпы и периодонта
Первоочередная проблема, возникающая с самого начала эндодонтического лечения, связана с риском бактериальной контаминации, даже в зубах с жизнеспособной пульпой. Уже 40 лет назад, в I960 году, когда культуральные методы микробиологических исследований были не столь совершенны как в настоящее время, Engstrom показал, что жизнеспособная воспаленная пульпа при закрытой полости зуба характеризуется микробным обсеменением более чем в 7% случаев. Этот показатель характеризуется экспоненциальным ростом до 80% при хроническом пульпите, остром верхушечном периодонтите и некрозе пульпы. Инфицирование корневых каналов обычно связано с наличием рентгенологических признаков периапикальной патологии и клинической симптоматикой острого или хронического периодонтита. Согласно классификации Abou-rass and Bogen, периапикальные очаги подразделяются на открытые и закрытые независимо от связанной с ними симптоматики. Открытые очаги чаще всего содержат оппортунистическую микрофлору полости рта, проникающую непосредственно через пульпу или через экстрапульпарные входные ворота. К данной группе относятся очаги инфекции, связанные с некачественным эндодонтическим лечением и нарушением краевого герметизма реставраций после эндодонтического лечения (Рис 1,2).
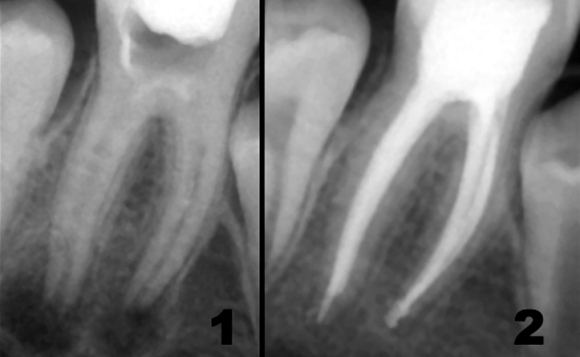
Рис. 1
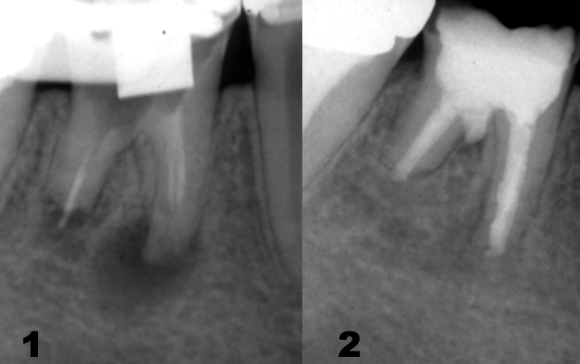
Рис. 2
Закрытые очаги характерны для зубов с патологией пульпы или верхушечного периодонта, не имеющих признаков прямого проникновения микрофлоры полости рта. К данной категории относятся очаги в области зубов с явлениями выраженной облитерации каналов или с посттравматическим некрозом пульпы (Рис 3), а также сохраняющиеся периапикальные очаги после адекватно проведенного эндодонтического лечения. Проблемы при лечении открытых и закрытых очагов существенно различаются. Открытые очаги связаны с обсеменением микрофлорой полости рта, поэтому прогноз лечения таких очагов благоприятен при условии полноценной очистки системы корневых каналов и герметичной обтурации всех входных ворот проникновения инфекции с целью профилактики дальнейшего инфицирования.
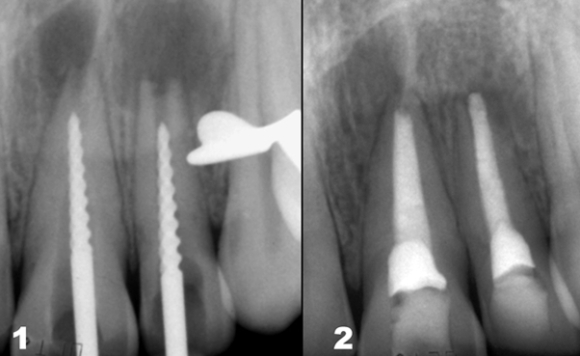
Рис. 3
Происхождение и локализация микрофлоры, связанной с закрытыми очагами, зачастую остается тайной и является одним из самых спорных вопросов в научных кругах: присутствуют ли бактерии в периапикальной гранулеме, и если да, то в каком количестве? И, в случае бактериальной обсемененности, локализуются ли микроорганизмы в области корня или существует первичная перирадикулярная инфекция, в то время как апекс остается стерильным?
Abou-Rass et Al провели исследование ряда закрытых очагов, отобранных по жестким критериям. В ходе исследования бактериальное обссе было выявлено во всех случаях, при чем 63% составила облигатно анаэробная микрофлора, а 36% — факультативно анаэробные возбудители. Среди выявленных микроорганизмов авторы указывают штаммы
Actinomyces (22.7%)
Propionibacterius (18.2%)
Streptococcus (13.6%)
Staphilococcus (4.6%)
Porphiromonas gingvalis (4.6%)
и Грам-отрицательные энтеробактерии. Все изученные образцы взятые в области верхушки корня, содержали микроорганизмы, в то время как из области хирургического доступа и из периферической зоны апикальных очагов выделить инфекцию не удалось. Данные, полученные Abou-Rass, дают основание предполагать, что периапикальная инфекция локализуется, главным образом, в области верхушки корня, и только в отдельных случаях микроорганизмы распространяются вглубь периапикальных тканей. Противоположные данные, полученные рядом авторов, которые выявили инфекцию эндодонтического происхождения в периапикальных очагах, могут объясниться высокой вероятностью контаминации в ходе получения образцов из-за сложности строгого соблюдения протокола забора материала. Этой противоречивости мнений соответствуют противоположные терапевтические подходы Если считать что гранулема может быть первично инфицирована при стерильности верхушки корня, можно назначить пациенту курс антибиотикотерапии хоть на несколько недель с полной уверенностью, что это приведет к ликвидации гранулемы. Напротив, если первичным источником инфицирования мы считаем систему корневых каналов, нам остается всего две возможности: очистить и дезинфицировать каналы либо, если это невозможно (облитерированные или непроходимые каналы, сложная топография каналов), применить периапикальную хирургию.
2 — Характеристики системы корневых каналов и твердых тканей зуба
Система корневого канала может иметь очень сложную морфологию, которая часто характеризуется наличием боковых каналов и анастомозов, рассыпным строением в апикальной части. Полноценная очистка, формирование и стерилизация корневых каналов возможны далеко не во всех случаях (Рис. 4).
Рис. 4
Гистологическое строение корневого канала еще более сложно: как видно, от центра канала к периферии оно представлено следующими тканями: ткань пульпы, слой одонтобластов, предентин, т.е. зона дентина, соответствующая по минеральному составу понятию «граница минерализации дентина» (Рис. 5)

Рис. 5
и дентин со сложной тубулярной системой строения. Число и ориентация дентинных канальцев может варьировать в зависимости от физиологических особенностей или патологических изменений. По данным Garberoglio and Brannstrom, концентрация дентинных канальцев может составлять от 20000 до 40000/мм2, а средний диаметр находится в пределах 2-4 мкм. Дентинные канальцы создают сложную трехмерную коммуникационную систему между полостью рта и системой корневых каналов: в зубах с жизнеспособной пульпой просветы дентинных канальцев заполнены отростками одонтобластов и дентальным ликвором, которые обеспечивают защиту пульпы путем формирования преграды для проникновения бактерий и их токсинов. (Рис. 6).
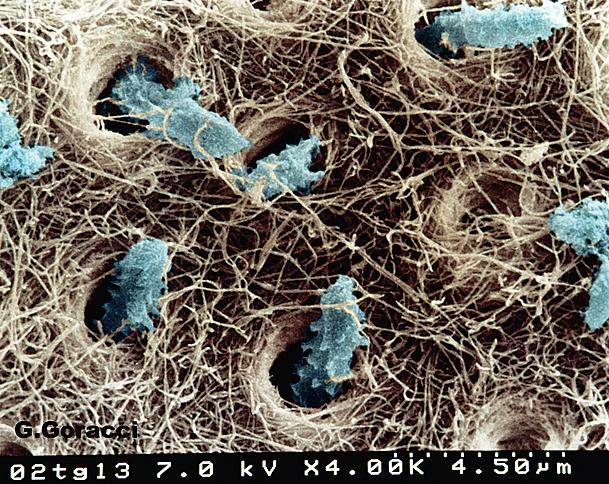
Рис. 6
В случае гибели пульпы происходит обезвоживание дентинных канальцев, в просвете которых остается только тканевой распад отростков одонтобластов, по просвету канальцев легко происходит миграция микроорганизмов, токсинов, и медикаментов, способных к пенетрации дентина (Рис. 7).

Рис. 7
Инфицирование дентинных канальцев различными видами микроорганизмов продемонстрировано во многих исследованиях: в работе Buck сообщается о способности проникать в дентинные канальцы, характерной для Micrococcus Luteus и Bacillus megaterium, в работе Berkiten — для Streptococcus sanguis, Prevotella intermedia, Actinomyces naeslundii, в работе Siqueira — для Porphyromonas endodontalis, Fusobacterium nucleatum, Actinomyces israelii, Porphyromonas gengivalis, Propionibacterium acnes, Enterococcus faecalis, в работе Waltimo — для Candida Albicans. В целом, дентинные канальцы могут содержать бактерии, проникающие в них как из полости рта, так и из системы корневых каналов. Поскольку данные бактерии могут приводить к неэффективности эндодонтического лечения, они должны быть устранены.
3 — Удаление эндодонтического смазанного слоя
В ходе препарирования твердых тканей зуба ручными или машинными инструментами (высокоскоростными или низкоскоростными борами, кюретами, эндодонтическим инструментарием), на поверхности дентина формируется микроскопический слой из опилок (Рис. 8).
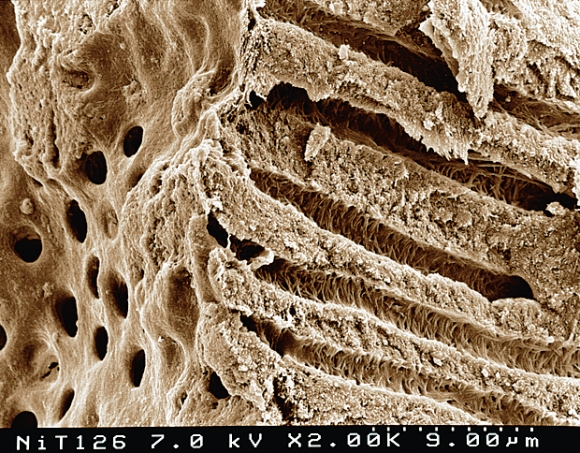
Рис. 8
Толщина и состав этого слоя меняются в зависимости от свойств обрабатываемых твердых тканей и характеристик режущего инструментария, но обязательной чертой является присутствие в нем органических и неорганических компонентов. Смазанный слой, формирующийся при эндодонтической обработке, характеризуется высоким содержанием органических компонентов в виде фрагментов пульпы, одонтобластов, слабоминерализованного предентина. В то же время имеются и неорганические компоненты, источником которых является дентин. В связи с этим, для удаления смазанного слоя со стенок корневого канала требуется использование растворов, эффективных в отношении как органических, так и минеральных компонентов. Смазанный слой корневого канала, впервые описанный MacComb and Mader , плотно соединен со стенкой корневого канала через «смазанные пробки», погружающиеся в дентинные канальцы. Толщина поверхностного смазанного слоя составляет от 1 до 6 мкм, в то время как глубина его проникновения в дентинные канальцы может быть выше, достигая 50 мкм (Рис. 9 ).
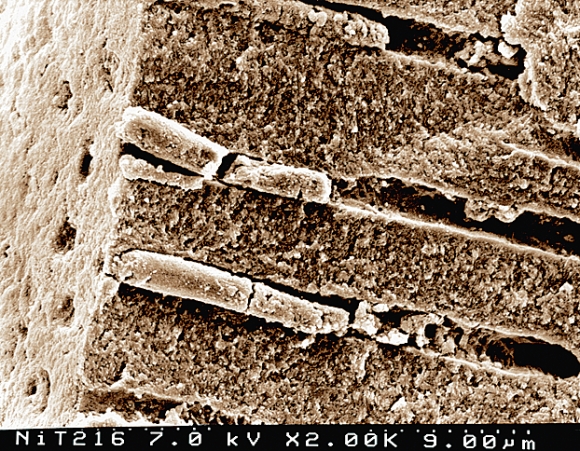
Рис. 9
По данным ряда авторов, смазанный слой корневого канала не следует удалять, так как он уменьшает проницаемость дентинных канальцев для микроорганизмов и их токсинов за счет запечатывания дентинных трубочек. Но на СЕМ микрофотографии поверхности дентина корневого канала, покрытой смазанным слоем, легко заметить, что данный слой не имеет равномерной гомогенной плотной консистенции, а, напротив, во многих участках прерывается, то есть не формирует герметичного барьера. Более того, смазанный слой корневого канала может содержать микроорганизмы и являться для них питательной средой, а также нарушать адгезию пломбировочных материалов к стенкам корневых каналов (Рис. 10).
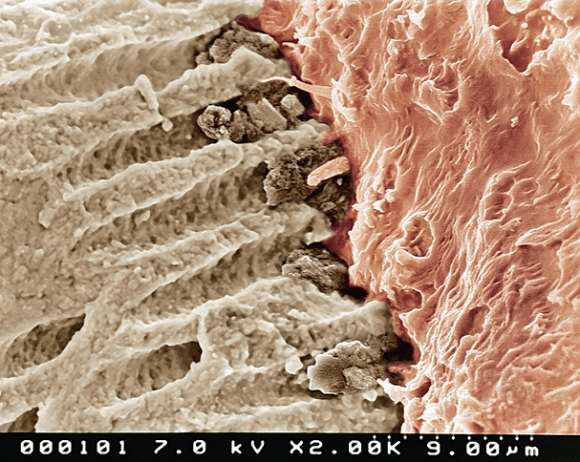
Рис. 10
В связи с вышесказанным, смазанный слой корневого канала необходимо полностью удалять. После удаления смазанного слоя, на стенках корневого канала четко видны просветы хорошо очищенных дентинных канальцев с зияющими и умеренно расширенными устьями. Перитубулярный дентин, высоко чувствительный к ЭДТА или растворам кислот, полностью растворяется. В то время как интертубулярный дентин может демонстрировать умеренные явления деминерализации. Пломбировочные материалы, такие как корневые цементы или гуттаперча, при правильной методике применения, легко проникают и обтурируют открытые дентинные канальцы, способствуя герметичности корневой пломбы и предотвращая возможность дальнейшего проникновения инфекции в систему корневых каналов (Рис. 11,12).
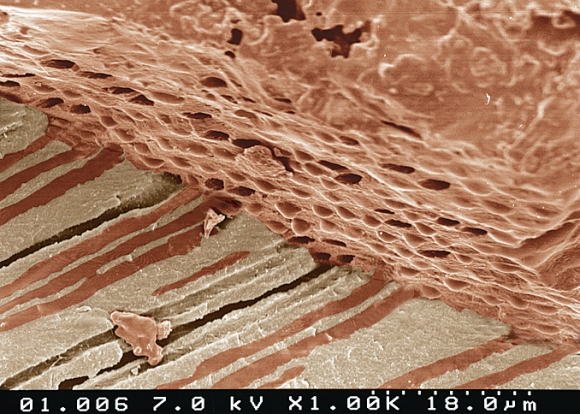
Рис. 11
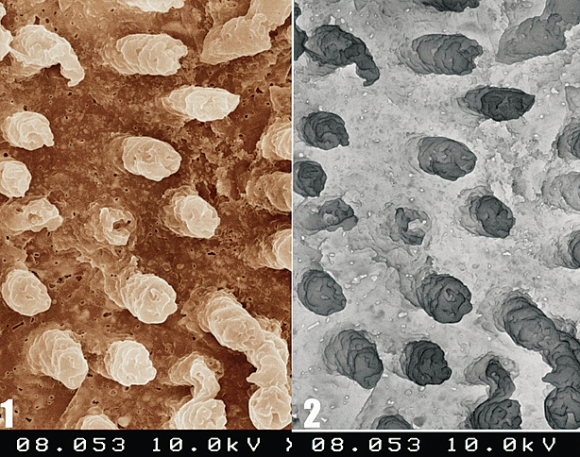
Рис. 12
4 — Ирригационные растворы
а) Вода
Вода характеризуется высокой биосовместимостью и низкой стоимостью. Это делает ее вполне пригодной для механического струйного вымывания бактерий за счет возвратного тока жидкости. К сожалению, обычное промывание канала водой не обеспечивает полной стерилизации системы корневых каналов или устранения смазанного слоя, сформировавшегося в ходе инструментальной обработки. Тем не менее, мы считаем струйное промывание канала водой важным компонентом процесса очистки и формирования корневых каналов, который обеспечивает удаление крупных тканевых фрагментов, вымывание временных пломбировочных материалов из каналов, а также может быть использован для неотложного промывания периапикальной области при случайном выведении за верхушку корня раствора гипохлорита натрия. Для использования всех преимуществ струйного промывания мы настоятельно рекомендуем использовать хирургический ирригатор Stropko, предпочтительно, с тонкой пластиковой иглой для уменьшения давления воды и воздуха.
б) Хлорсодержащие растворы
■ Гипохлорит натрия
Гипохлорит натрия (NaOCl) обладает одновременно окислительными и гидролизирующими свойства ми: он оказывает бактерицидный и протеолитический эффекты. Раствор был предложен для применения в качестве средства для промывания ран не позже, чем в 1915 году, а в качестве ирригационного раствора для эндодонтии начал применяться около 1920 года. Гипохлорит натрия традиционно полу чают путем пропускания хлорного газа через раствор гидроксида натрия, в соответствии со следующей реакцией:
Сl2 + 2NaОН -> NaОСl + NaСl + Н2О (Clarkson).
Готовые к употреблению растворы гипохлорита натрия для эндодонтии имеют выраженную щелочную реакцию, гипертонические свойства и номинальную концентрацию 1-5% активного хлора. Важно помнить, что многие растворы NaОСl, применяемые для ирригации корневых каналов, являются домашними отбеливателями и со держат другие компоненты, такие как стабилизаторы (натрий хлорат и натрий гидроксид), очищающие добавки (сурфактанты, жирные кислоты), отдушки (ароматизаторы). В связи с этим предпочтительно использование растворов, специально разработанных для эндодонти-ческого применения и имеющих указание о сроке годности и концентрации на упаковке. Популярность NaОСl в качестве ирригационного раствора для эндодонтии определяется общедоступностью и дешевизной раствора. Во многих исследованиях продемонстрированы его антисептические и растворяющие свойства. В частности, NaОCl оказывает быстрый бактерицидный эффект в отношении вегетирующих форм, спорообразующих бактерий, грибов, простейших и вирусов (включая ВИЧ, ротавирус, НSV-1 и -2, вирусы гепатита А и В). Точный механизм антимикробной активности NaОCl не до конца ясен, но он может определяться формированием гипохлористой кислоты и высвобождением активного хлора, который приводит к окислению сульфгидрильных групп важных бактериальных ферментов. Однако, нет единого мнения по вопросу об оптимальной концентрации гипохлорита натрия для применения в эндодонтии. Spandberg продемонстрировал, что 5,25% раствор гипохлорита натрия является слишком токсичным, а устранение наиболее типичных для инфицированных корневых каналов бактериальных штаммов возможно с применением раствора в значительно меньшей концентрации. С другой стороны, Тh и Уеsilsoy показали, что 5,25% NaОCl не отличался по токсичности от раствора гипохлорита меньших концентраций, а также от раствора хлоргексидина биглюконата. Даже данные по антимикробной активности носят противоречивый характер. В некоторых исследованиях не выявлено существенных различий по антибактериальной эффективности между 0,5 и 5% NaОCl, в то время как в других исследованиях сообщается о том, что антисептический эффект значительно снижается по сле разведения. Heling подчеркивает важность длительности экспозиции, которая не должна быть менее 10 мин, с тем, чтобы дать возможность гипохлориту натрия оказать бактерицидное действие даже в от ношении резистентных видов микроорганизмов. Гипохлорит натрия обладает выраженными растворяющими свойствами в отношении остатков пульпы, даже находящихся в боковых и дополнительных каналах (Рис. 13,14), а также отчасти эффективен в отношении коллагенового матрикса предентина; однако, его воздействие на калькосфериты и на неорганический матрикс смазанного слоя незначительно (Рис. 15).
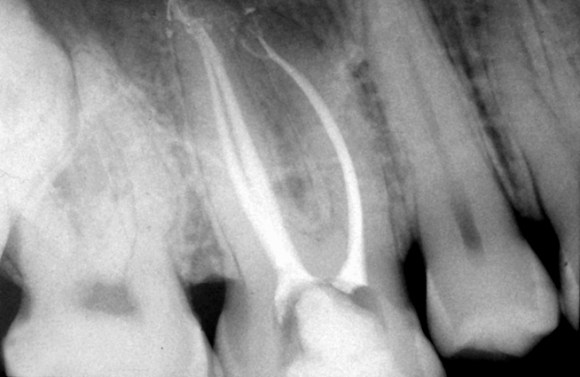
Рис. 13
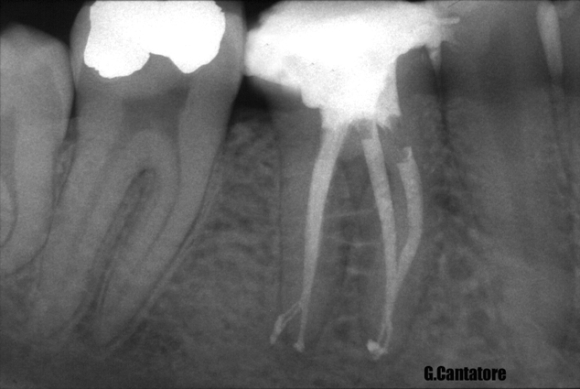
Рис. 14
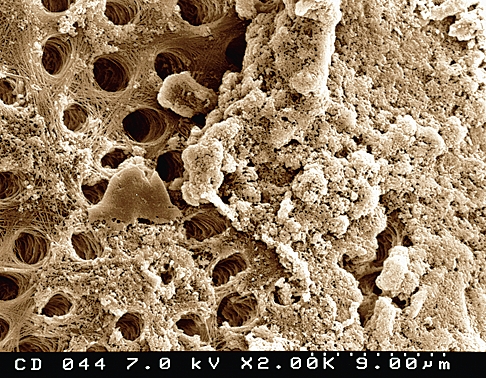
Рис. 15
Растворяющий эффект определяется концентрацией гипохлорита натрия: максимальная выраженность эффекта проявляется у 5% раствора NaОCl. Для повышения эффективности гипохлорита натрия как растворителя тканевого распада рекомендуется:
использовать подогретый раствор с температурой около 40°C;
активировать и нагревать раствор путем использования ультразвуковых файлов;
использовать временное пломбирование корневых каналов гидроксидом кальция для использования преимуществ синергического эффекта этих двух веществ;
использовать в сочетании с по верхностно-активными агентами для усиления пенетрации гипохлоритом натрия дентинных канальцев, тем самым сокращая число интратубулярных бактерий.
■ Натрий дихлоризоцианурат
Натрий дихлоризоцианурат от носится к числу хлор-продуцирующих дезинфектантов и применяется, обычно, для дезинфекции загрязненных поверхностей и растворов. Coates сообщает о том, что раствор натрий дихлоризоцианурата содержит 4,000 ppm активного хлора, проявляя при этом бактерицидный эффект, сходный с раствором NaOC, содержащим 17,000 ppm активного хлора. В присутствии органического материала антисептические и растворяющие свойства натрий дихлоризоцианурата значительно выше, чем у NaOCI. HeIing в недавнем исследовании оценивал и сравнивал бактерицидный эффект натрий дихлоризоцианурата и NaOCI относительно следующих возбудителей: Streptococcus sobrinus, Streptococcus saIivarius, Enterococcus faecaIis, Streptococcus mutans. Полученные данные свидетельствуют о том, что минимальная ингибирующая и бактерицидная концентрация относительно изученных бактерий оказались сходными у обоих изученных растворов. В целом, натрий дихлоризоцианурат может быть эффективной альтернативой NaOCI, даже если для подтверждения предварительных данных потребуются дальнейшие исследования и накопление клинического опыта.
в) Перекись водорода
Перекись водорода широко при меняется в качестве раствора для промывания корневых каналов по очередно с NaOCl благодаря кратковременному, но выраженному эффекту пенообразования при смешении данных веществ, что способствует механическому вымыванию тканевых остатков и микроорганизмов из канала. Согласно Grossman преимущества сочетанного применения NaOCl и H2O2 таковы:
■ Пенообразование
■ Растворяющий эффект NaOCl
■ Дезинфицирующий эффект обоих растворов
■ Отбеливающий эффект обоих растворов.
Взаимодействие между NaOCl + H2O2 классически описывается следующей реакцией:
NaOCl + H2O2 -> NaCl + H2O + 2•O•2 (где O• — это атомарный кислород, превращающийся в O2). Shiozawa настаивает на том, что реакция значительно сложнее и ведет к образованию двух видов активного кислорода (ROS): радикала анион супероксида (O2-) и радикала гидроксила (•OH). Оба ROS активны и демонстрируют более выраженный антибактериальный эффект по отношению к штаммам Streptococcus и к Staphylococcus aureus, чем чистая перекись водорода. Однако, активные радикалы ROS могут вызывать раздражение периапикальных тканей; в связи с этим рекомендуется промывать корневой канал чистой дистиллированной водой перед пломбированием. Приемлемой альтернативой H2O2 является Glyde (Dentsply-Maillefer®). Glyde представляет собой прозрачный гель, содержащий 15% ЭДТА и пероксид карбамида на водорастворимой метилцеллюлозной основе. Чередование Glyde и раствора гипохлорита натрия обеспечивает выраженный и продолжительный эффект пенообразования, а также бактерицидное действие, в то время как 15% ЭДТА обеспечивает растворяющий эффект в отношении минерализованных опилок. Кроме того, Glyde обладает полезными смазывающими и отбеливающими свойствами. Единственным ограничением в использовании Glyde является слабо выраженная тенденция к недостаточной очистке апикальной трети корневого канала, как было проде монстрировано нами в одном из по следних исследований. Для полного удаления указанных загрязняющих частиц (не вполне ясно, являются ли они остатками геля или смесью геля и «смазанного слоя») необходимо использовать жидкую форму ЭДТА, активированную ультразвуковыми файлами (Рис. 16).
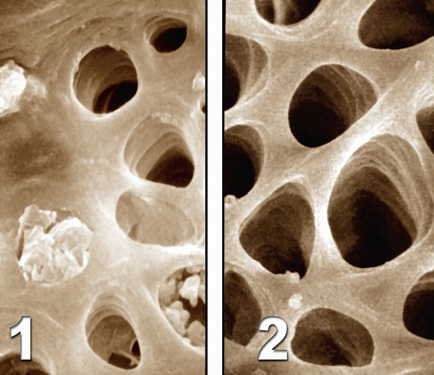
Рис. 16
г) Компоненты ЭДТА
ЭДТА обычно применяется в эндодонтии в виде жидкости или геля в качестве хелатного агента, извлекающего ионы кальция из гидроксилапатита, тем самым рас творяя минеральную фракцию смазанного слоя корневого кана ла. Эффективность растворов ЭДТА зависит, главным образом, от их рН. Оптимальное значение рН должно находиться в пределах от 6 до 10. Большинство готовых форм основаны на динатриевой соли ЭДТА с нейтральным значением рН и обеспечивают хелатное изомолярное связывание с кальцием до полного расходования ЭДТА. Этим объясняется важность постоянного обновления раствора в корневом канале для использования активного ЭДТА. O’Connell в одном из последних исследований указывает на то, что изолированное применение ЭДТА без гипохлорита натрия ни в одном случае не обеспечило полного удаления смазанного слоя корневого канала. Этим объясняется целесообразность чередования ЭДТА-содержащих агентов и гипохлорита в ходе эндодонтической обработки; их сочетанный эффект обеспечивает великолепную степень очистки дентинных стенок в апикальной трети корневого канала при условии, что оба вещества доводятся до апекса и активируются с помощью ультразвука или ручными файлами (Рис. 17).

Рис. 17
Поверхностно активные вещества, такие как Centrimide, часто добавляют в готовые формы растворов ЭДТА (Largal Ultra® Septodont или R-EDTA®) для усиления их проникающей способности в дополнительные каналы и дентинные канальцы. К числу ЭДТА-содержащих гелей относится RC-Prep® производства Premier Dental и Glyde® производства Dentsply Maillefer.
д) Кислотные компоненты
Кислотами, применяемыми в эндодонтии для промывания каналов, являются фосфорная и лимонная в концентрации от 6% до 30%. Растворы кислот высоко эффективны для удаления минерального компонента смазанного слоя корневого канала и при лечении облитерированных каналов. Тем не менее, поскольку их эффективность как антисептиков и органических растворителей ограничена, рекомендуется сочетанное использование с гипохлоритом натрия. В одном из недавних исследований мы изучили эффективность двух различных комбинаций ирригационных растворов (NaOCl+ЭДТА и NaOCl + ортофосфорная и лимонная кислота) для удаления смазанного слоя. Полученные нами результаты свидетельствуют о том, что обе концентрации оказались эффективны, хотя применение ЭДТА характеризова лось более щадящим воздействием на перитубулярный и интертубулярный дентин, в то время как ортофосфорная кислота продемонстрировала более агрессивный эффект с признаками деминерализации дентина на стенках канала (Рис. 18).

Рис. 18
Поскольку растворы кислот быстро инактивируются в присутствии минерализованных опилок, необходимо периодически обновлять раствор, особенно если он замутнен или начинает высыхать. После применения кислот рекомендуется промыть канал дистиллированной водой, так как существует тенденция к кристал лизации и выпадению преципита та на стенках канала.
е) Хлоргексидин
Антибактериальный эффект хлоргексидина глюконата в концентрации от 0,2 до 2% показан во многих исследованиях. Leonardo в исследовании «in vivo» показал устранение 100% стрептококка мутанс и 78% анаэробных микроорганизмов при использовании 2% раствора хлоргексидин глюконата. Vahdaty подтвердил дезинфицирующий эффект хлоргексидина относительно бактерий, находящихся в дентинных канальцах, Hakan-Sen выявил противогрибковый эффект относительно Candida albicans. По скольку растворяющая эффективность хлоргексидина относительно органических и минерализованных тканей не выражена, рекомендуется чередовать его с растворами NaOCl. Более того, два указанных раствора при сочетанном применении характеризуются суммационным эффектом, возможно, благодаря формированию хлоргексидинхлоридных компонентов, которые по вышают ионизирующие свойства молекулы хлоргексидина. К числу готовых форм на основе хлоргексидина относится «Cetrexidin®» производства VEBAS. Препарат содержит 0,2% хлоргексидин в сочетании с 0,2% цетримидом, поверхностно активным аммином, который снижает поверхностное натяжение продукта, повышая его проникающую способность и антисептические свойства. Хлоргексидин может быть, наконец, использован для краткосрочного временного заполнения корневых каналов. Фактически, данный препарат подавляет микробную активность in vivo в течение 48 часов после применения.
ж) Спирт
Применение спирта в качестве ирригационного раствора не рекомендуется. Yesilsoy обнаружил, что 11,6% спирт был крайне неэффективен относительно большинства микроорганизмов; Ayhan получил более благоприятные результаты только при условии повышения концентрации (21%). С другой стороны, рекомендуется финальное промывание корневого канала спиртом для максимального обезвоживания стенок канала, что способствует более глубокому проникновению корневого цемента в дентинные канальцы и улучшает герметичность обтурации.
5 — Оптимизация ирригацион ных растворов
В 1917 Walter Hess опубликовал изображения системы корневых каналов после перфузии красителем Indian ink, которые убедительно доказали высокую степень разнообразия и сложности морфологии корневых каналов, что в ряде случаев делает невозможными их полноценную очистку и обтурацию. Kim на основе иллюстраций Hess создал трехмерные изображения корневых каналов с помощью компьютерного моделирования. Компьютерный анализ этих моделей показал, что до 93% боковых каналов и 96% ответвлений апикальной дельты находятся в концевых 3 мм корня. Таким образом, исключительно важно довести достаточный объем ирригационного раствора в верхушечную треть корня для оптимизации очистки канала. Возможными путями повышения очищающей эффектив ности ирригационных растворов являются:
Увеличение диаметра апикальной части корневого канала
Повышение общего объема ирригационного раствора
Выведение ирригационного раствора непосредственно в апикальной области
Удлинение экспозиции ирригационного раствора с микроорганизмами и тканевым распадом
Механическая активация ирригационных растворов.
Первые три способа взаимосвязаны: при расширении просвета апикальной части канала появля ется возможность погрузить иглу ирригационного шприца глубже и непосредственно подвести ирригационный раствор к верхушечному отделу канала. Использование никель-титановых инструментов повышенной конусности легко и быстро обеспечивает «глубокое формирование», позволяющее по грузить эндодонтическую иглу калибра 27 или 30 непосредственно в апикальную треть даже искривленных корневых каналов (Рис. 19-21).
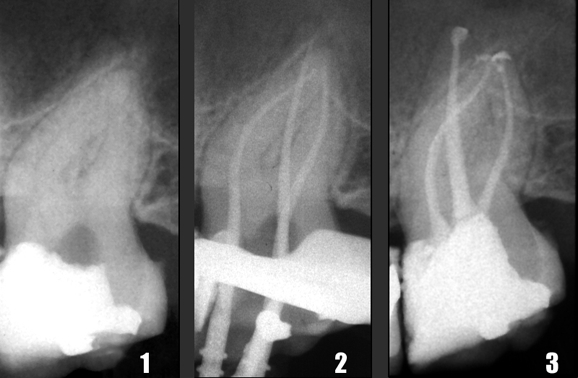
Рис. 19
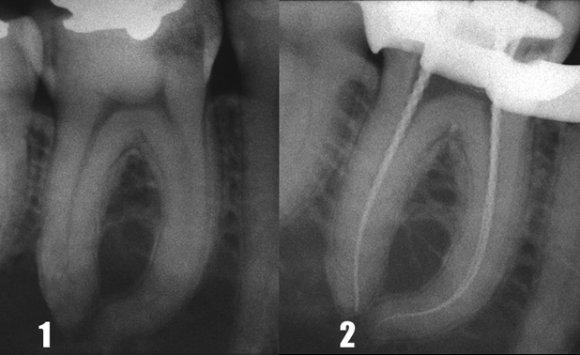
Рис. 20
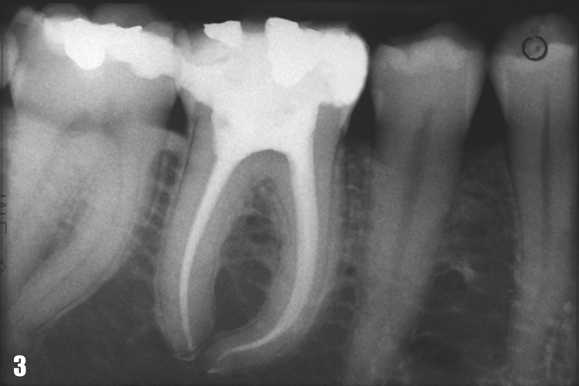
Рис. 21
Что касается предпочтительного типа игл, мы рекомендуем варианты с закругленной запаянной верхушкой и боковым расположением отверстия для профилактики выведения ирригационного раствора в периапикальные ткани. Шприцы с ирригационным раствором в идеале должны храниться при температуре 37°С в специальном электротермостате: «Siringe warmer» (Vista-Dental®) или «Appli-Vac System» (Vista-Dental®), который позволяет использовать до 6 различных ирригационных растворов, просто переключаясь с одного на другой с помощью кнопок на ирригационном пистолете. Для изогнутых корневых каналов можно рекомендовать использование гибких никель-титановых игл (Vista-Dental®). Инсулиновые иглы (слишком короткие), иглы для анестезии (слишком острые) или иглы для обычного шприца (слишком толстые) применять не рекомендуется. Когда раствор находится в апикальной трети канала, его необходимо активировать ультразвуковым файлом. Можно использовать ультразвуковые приборы, обеспечивающие непосредственную подачу NaOCl или ЭДТА в канал через наконечник либо просто заполнить канал ирригационным раствором, погрузить в него ультразвуковой файл и некоторое время удерживать его в работающем состоянии, до тех пор пока раствор не станет мутным, что указывает на необходимость его освежения. Не вполне понятен механизм активации растворов ультразвуком: важным со ставляющими считается развитие акустических вихревых потоков, процесс кавитации (формирование микропузырьков), механическое перемешивание и нагревание раствора. Используя 5% и 12% раствор гипохлорита натрия и ультразвук, Huque на удаленных зубах проде монстрировал полное устранение смазанного слоя и дезинфекцию поверхности канала, наружных и глубоких слоев стенки корневого канала. Сходные результаты получены Turkun, Ahmad, Cameron. Рекомендуется использовать эндодонтический файл только после завершения препарирования корневых каналов, чтобы при глубоком погружении в канал инструмент не контактировал со стенками. Свободныеосциллирую щие колебания верхушки эндодонтического ультразвукового файла улучшает акустические вихревые потоки и, в то же время, снижает риск повреждения стенки канала (Рис. 22).

Рис. 22
6 — Последовательность ирригации в ходе препарирования корневых каналов
Удалить крышу пульпарной камеры и применить струйное промывание водой или гипохлоритом натрия для удаления остатков пульпы и выявления устьев корневых каналов;
Начать инструментальную обработку просвета канала, чередуя ее только с гипохлоритом натрия;
Приступая к иссечению дентина, заполните просвет канала материалом Glyde;
Продолжайте инструментальную обработку до тех пор, пока Glyde не станет мутным и вязким;
Промывайте канал гипохлоритом натрия до прекращения пенообразования;
Завершите инструментальную об работку, контролируя, чтобы канал всегда оставался заполнен Glyde и промывая канал гипохло ритом натрия после каждых 3-4 инструментов;
В инфицированных каналах чередуйте промывание канала NaОСl и хлоргексидином.
7 — Ирригация перед пломбированием
Перед пломбированием у нас остается последний шанс удалить смазанный слой и дезинфицировать систему корневого канала; обычно для этой цели рекомендуется сочетанное применение раствора гипохлорита натрия с ЭДТА или лимонной кислотой. Эффективность завершающей ирригации зависит от химических свойств и концентрации раствора, а также от общего объема растворов и длительности экспозиции в канале (Рис. 23-26).
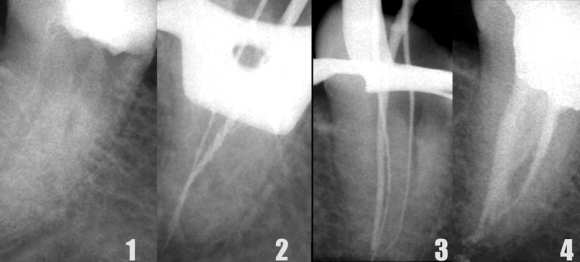
Рис. 23
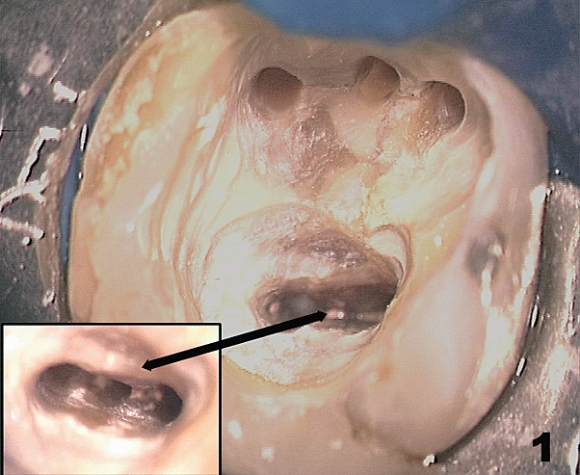
Рис. 24
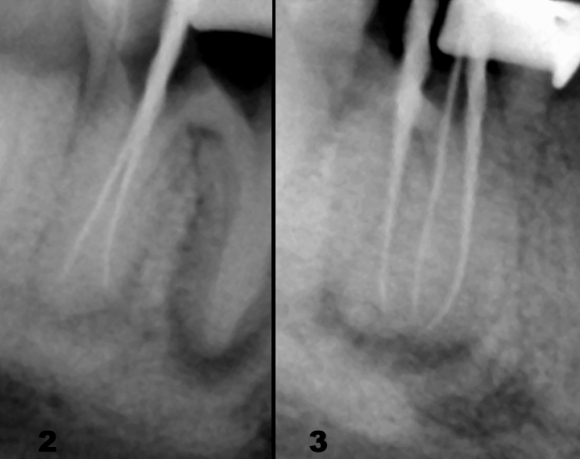
Рис. 25
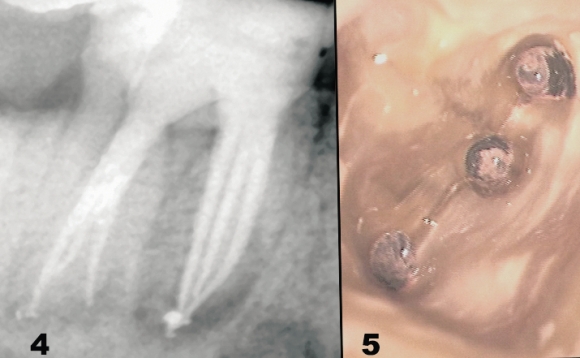
Рис. 26
Мы рекомендуем следующую последовательность:
Промыть канал и полость зуба 8-10 мл 10-15% раствора ЭДТА, активируя раствор ультразвуковыми файлами
Промыть 10 мл 5% гипохлорита натрия
Промыть дистиллированной водой
Высушить канал стерильным бумажным штифтом и запломбировать.
Заключение
Важность и роль ирригационного раствора в очистке системы корневых каналов — одна из наиболее дискуссионных тем в эндодонтии. Мы глубоко убеждены в том, что ирригационные растворы могут оказать существенную помощь в ходе эндодонтического лечения, за счет бактерицидного эффекта и создания благоприятных условий для герметичного пломбирования корневых вследствие удаления смазанного слоя, при соблюдении следующих условий:
Применение правильной последовательности
Использование достаточного объема и концентрации для каждого раствора
Введение растворов в глубокие отделы корневого канала через эндодонтическую иглу
«Глубокое формирование» корне вого канала для облегчения его глубокого промывания
Начало ирригации как можно раньше после удаления крыши пульпарной камеры
Длительной окончательной ирригации — менее 5 мин.
Статья опубликована в «Новости Dentsply» № 10 2004 г.
